8月12日訊 8月10日,據(jù)中國質(zhì)量報消息,深圳市市場監(jiān)管局強化“藥械化”領(lǐng)域日常監(jiān)管實現(xiàn)全覆蓋,2019年平均每天開展檢查43次。
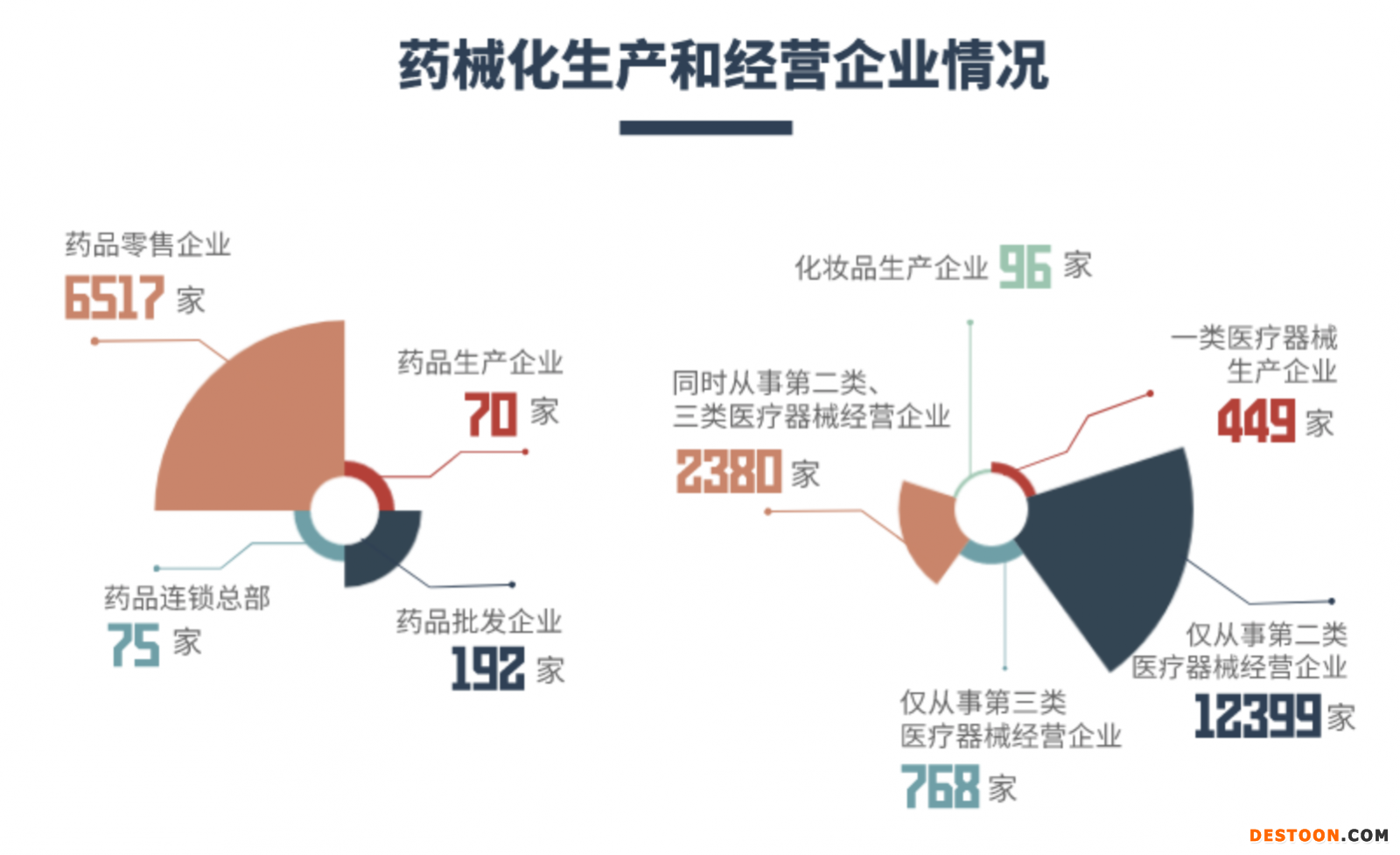
深圳市市場監(jiān)管局發(fā)布2019對深圳市藥械化(藥品、醫(yī)療器械和化妝品)生產(chǎn)和經(jīng)營企業(yè)情況、藥械化企業(yè)日常監(jiān)督檢查情況、藥械化抽樣檢驗情況、藥械化案件查處情況等進行公示。
2019年,深圳市共組織開展藥械化日常監(jiān)督檢查15845家次,平均每天開展監(jiān)督檢查43次;共開展藥械化抽樣檢驗11318批次,查處藥械化案件804宗,罰沒金額逾2000萬元。
2019年,深圳市共查處醫(yī)療器械案件99件,貨值金額725.71萬元,罰款金額775.09萬元,沒收違法所得金額607.66萬元,取締無證經(jīng)營2戶,責(zé)令停產(chǎn)停業(yè)9戶。
全面整治械企
日前,國家市場監(jiān)督管理總局發(fā)布了《防疫物資產(chǎn)品質(zhì)量和市場秩序?qū)m椪涡袆拥湫桶讣贰?jù)官網(wǎng)披露,國家要求各地市場監(jiān)管部門全面排查防疫物資產(chǎn)品質(zhì)量和市場秩序存在的隱患,全面整治生產(chǎn)、流通、消費中存在的突出問題。
各地市場監(jiān)管部門迅速行動,持續(xù)加大監(jiān)管力度,依法從嚴從重從快查處了一批違法案件,切實維護了防疫物資市場秩序。
據(jù)賽柏藍器械觀察,在本次通報中,北京市延慶區(qū)市場監(jiān)管局查處未經(jīng)許可從事第三類醫(yī)療器械經(jīng)營活動和經(jīng)營未依法注冊醫(yī)療器械案。
涉案當事人未取得《醫(yī)療器械經(jīng)營許可證》,銷售及捐贈“冠狀病毒核酸檢測試劑盒”和“七種冠狀病毒核酸檢測試劑盒”共計95盒,貨值共計93322.42元。
違反了《醫(yī)療器械監(jiān)督管理條例》第三十一條第一款和第四十條的規(guī)定。鑒于當事人及時召回“冠狀病毒核酸檢測試劑盒”65盒,召回比例較大,依法對當事人罰沒合計約140.8萬元。
企業(yè)問題頻出
賽柏藍器械基于公開信息統(tǒng)計,“無菌”和“植入”企業(yè)在飛檢中問題頻出,屬于《藥品醫(yī)療器械飛行檢查辦法》第八條中第七項情形:
?。ㄒ唬┩对V舉報或者其他來源的線索表明可能存在質(zhì)量安全風(fēng)險的;
?。ǘz驗發(fā)現(xiàn)存在質(zhì)量安全風(fēng)險的;
?。ㄈ┧幤凡涣挤磻?yīng)或者醫(yī)療器械不良事件監(jiān)測提示可能存在質(zhì)量安全風(fēng)險的;
?。ㄋ模ι陥筚Y料真實性有疑問的;
?。ㄎ澹┥嫦訃乐剡`反質(zhì)量管理規(guī)范要求的;
(六)企業(yè)有嚴重不守信記錄的;
?。ㄆ撸┢渌枰_展飛行檢查的情形。
自2015年《藥品醫(yī)療器械飛行檢查辦法》發(fā)布以來,所有飛檢結(jié)果均在在網(wǎng)上公開,其目的一方面是為了公示審核的“公平公正”性,另一方面也起著“警示警醒”行業(yè)中各企業(yè)的作用。
從檢查結(jié)果上看,其所有審核依據(jù)和問題都來源于《醫(yī)療器械現(xiàn)場檢查指導(dǎo)原則》及其附錄中的11大類:機構(gòu)與人員、廠房與設(shè)施、設(shè)備、文件管理、設(shè)計開發(fā)、采購、生產(chǎn)管理、質(zhì)量控制、銷售和售后服務(wù)、不合格品控制以及不良事件監(jiān)測、分析和改進,且至今為止尚無任何企業(yè)零缺陷通過檢查。輕則限期整改,重則停產(chǎn)整改。
從飛檢的原則來看,是“兩不兩直”,即:不得事先告知被檢查單位檢查行程和檢查內(nèi)容;直接進入檢查現(xiàn)場;直接針對可能存在的問題開展檢查;不得透露檢查進展情況和發(fā)現(xiàn)的違規(guī)線索信息等。
據(jù)悉,有醫(yī)療器械企業(yè)曾在一個月內(nèi)先后被歐盟公告機構(gòu)和國家藥監(jiān)局進行飛行檢查,且均是檢查組到達公司前臺企業(yè)才被告知。
其實,無論是抽檢還是飛檢,都像是一場開卷考試,所有的答案均都已經(jīng)在開始檢查的那一刻,就已成定局,如果企業(yè)想做到“來檢不驚”、“逢檢必過”,那必須在對企業(yè)自身質(zhì)量與管理體系上嚴格要求,不斷提升與突破。



 110102000668(1)號
110102000668(1)號