日前,和黃醫(yī)藥發(fā)布2021年業(yè)績報(bào)告,公司全年實(shí)現(xiàn)收入達(dá)3.56億美元,同比增長56%。已獲批上市的3款1類新藥總銷售額達(dá)9850萬美元,同比增長192%。在管線布局上,和黃醫(yī)藥專注于“First in class”創(chuàng)新發(fā)展模式,在抗腫瘤領(lǐng)域構(gòu)建多個(gè)1類新藥......國際化方面,1類新藥索凡替尼不久后將沖刺美國市場。此外,和黃醫(yī)藥于3月7日公告稱,公司收到阿斯利康支付1500萬美元里程碑付款。此項(xiàng)里程碑付款是針對(duì)和黃醫(yī)藥1類新藥賽沃替尼的全球III期研究而啟動(dòng)觸發(fā)。迄今為止,阿斯利康已向和黃醫(yī)藥支付了雙方許可和合作協(xié)議下首付款、開發(fā)總額的1.4億美元及首次商業(yè)銷售里程碑付款中的8500萬美元。
全年?duì)I收超20億元,3款1類新藥已獲批
3月3日,和黃醫(yī)藥發(fā)布2021年業(yè)績報(bào)告,公司全年實(shí)現(xiàn)收入達(dá)3.56億美元(約22.5億元),同比增長56%。
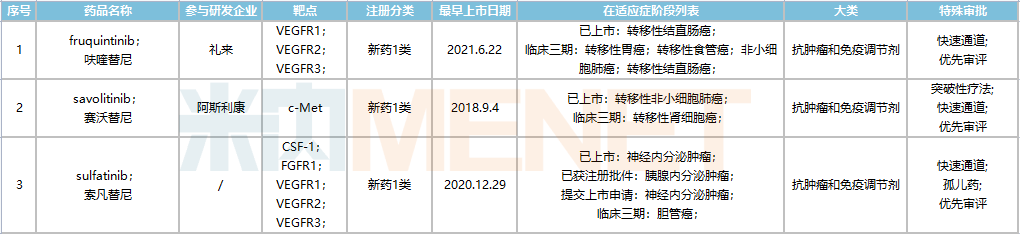
目前,和黃醫(yī)藥已在國內(nèi)上市了3款1類新藥,包括賽沃替尼(沃瑞沙)、呋喹替尼(愛優(yōu)特)及索凡替尼(蘇泰達(dá)),2021年總銷售額達(dá)9850萬美元(約6.2億元),同比增長192%。
和黃醫(yī)藥國內(nèi)上市藥品
來源:米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)庫
賽沃替尼是一種口服MET酪氨酸激酶抑制劑,于2021年6月國內(nèi)獲批上市,用于治療具有MET 14外顯子突變的晚期非小細(xì)胞肺癌,成為首個(gè)國產(chǎn)MET抑制劑,2021年銷售額達(dá)1590萬美元(約1億元)。
呋喹替尼于2018年9月獲批,成為當(dāng)時(shí)國內(nèi)頭批上市的自研1類抗癌新藥,2021年銷售額達(dá)7100萬美元(約4.5億元)。目前,呋喹替尼、索凡替尼兩款新藥已通過談判納入全國醫(yī)保目錄,其中呋喹替尼醫(yī)保支付標(biāo)準(zhǔn)為1984.5(1mg*21粒),索凡替尼為2035.32元每盒(50mg*42粒)。
11個(gè)在研新藥亮眼,搶占超10億大品種市場
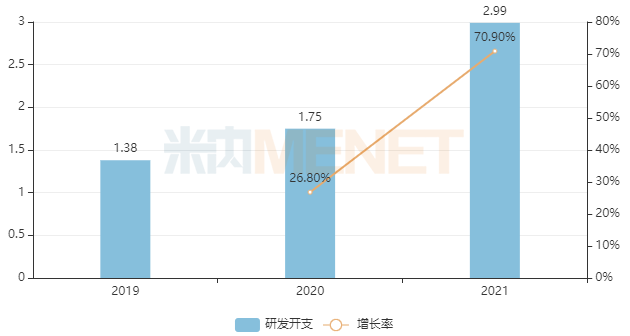
在研發(fā)創(chuàng)新上,和黃醫(yī)藥專注于“First in class”創(chuàng)新發(fā)展模式,近年來研發(fā)投入逐年增長。2021年和黃醫(yī)藥研發(fā)開支達(dá)2.99億美元(約18.9億元),同比增長70.9%,研發(fā)開支接近總營業(yè)收入。
和黃醫(yī)藥研發(fā)開支(單位:億美元)
來源:上市公司公告
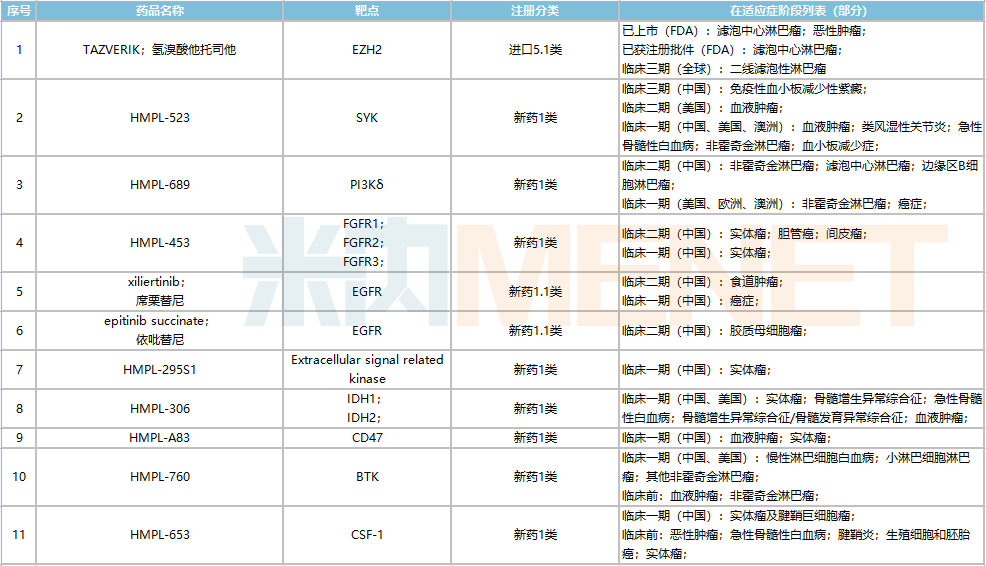
據(jù)米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)顯示,和黃醫(yī)藥新藥研發(fā)項(xiàng)目超過20個(gè),絕大多數(shù)為原研1類小分子藥物,產(chǎn)品管線涵蓋腫瘤、免疫調(diào)節(jié)、消化與代謝、皮膚以及造血系統(tǒng)等治療領(lǐng)域,其中進(jìn)展較快的在研候選藥項(xiàng)目約11個(gè),主要為抗腫瘤藥物。
從臨床進(jìn)展來看,高選擇性Syk抑制劑HMPL-523已步入臨床三期階段,用于治療免疫性血小板減少性紫癜,全球已獲批同靶點(diǎn)藥物僅有Rigel制藥的福他替尼鈉(TAVALISSE),該產(chǎn)品2021年全球銷售額達(dá)6300萬美元(約3.98億元);此外,HMPL-689、HMPL-453、席栗替尼、依吡替尼等處于臨床二期階段。
Tazemetostat(氫溴酸他托司他)為和黃醫(yī)藥唯一一款引進(jìn)的新藥,該藥為Epizyme授權(quán)的EZH2抑制劑,全球尚無同靶點(diǎn)藥物獲批上市。目前Tazemetostat已在美國、日本等國家地區(qū)上市,并于國內(nèi)啟動(dòng)治療濾泡性淋巴瘤的橋接研究,通過分析不同靶點(diǎn)藥物在復(fù)發(fā)難治性濾泡性淋巴瘤(FL)單用的臨床數(shù)據(jù)發(fā)現(xiàn)(ORR高達(dá)69%),該藥的單藥活性遠(yuǎn)高于BTK抑制劑(包括百濟(jì)神州澤布替尼)、PI3K抑制劑和BCL2抑制劑,并且在安全性上也更為顯著,未來上市后將會(huì)瓜分澤布替尼等超10億大品種在市場上的位置。
和黃醫(yī)藥部分候選藥物管線
來源:米內(nèi)網(wǎng)全球新藥研發(fā)數(shù)據(jù)庫
1類新藥即將赴美上市,中藥現(xiàn)代化領(lǐng)先探索
近年來,創(chuàng)新藥出海成為醫(yī)藥界的熱點(diǎn)話題。作為國內(nèi)創(chuàng)新藥頭部企業(yè),和黃醫(yī)藥2006年就已開始布局創(chuàng)新藥出海,當(dāng)時(shí)企業(yè)自研中藥穿心蓮制劑HMPL-004成功獲得FDA臨床研究批件,二期的療效指標(biāo)上數(shù)據(jù)亮眼,并受到國內(nèi)外醫(yī)藥界的強(qiáng)烈關(guān)注。
但由于劑型選擇和研究設(shè)計(jì)的缺陷,HMPL-004臨床三期研究在中期分析時(shí)被終止。即便HMPL-004的國際化道路未能順利完成,但該項(xiàng)目涵蓋了目前眾所關(guān)注的新藥出海、中醫(yī)藥現(xiàn)代化等探索經(jīng)驗(yàn),這放在十多年后的今天也十分具有借鑒意義。
中成藥想要進(jìn)入國際市場并非易事,中醫(yī)臨床醫(yī)生在用藥上根據(jù)患者具體病情增減藥味或某些藥味在劑量上適當(dāng)增減,講求以人為本的個(gè)體化用藥。若實(shí)現(xiàn)規(guī)模生產(chǎn)改制成群體用藥,就需按現(xiàn)代科學(xué)論證的方式對(duì)中成藥的藥效進(jìn)行評(píng)估,從中藥材到成品的整個(gè)過程需進(jìn)行嚴(yán)格的質(zhì)量控制,這是國產(chǎn)中藥及中成藥的出海挑戰(zhàn),也是目前中醫(yī)藥現(xiàn)代化的難點(diǎn)之一。
據(jù)不完全統(tǒng)計(jì),目前已有至少10款中成藥向FDA遞交IND申請(qǐng),其中不乏復(fù)方丹參滴丸、連花清瘟膠囊等“明星品種”。除了和黃醫(yī)藥HMPL-004,天士力的復(fù)方丹參滴丸在FDA臨床三期也面臨“折戟”,該藥通過前三期試驗(yàn)已經(jīng)用了20年時(shí)間,這給同類企業(yè)帶來了很大的打擊。迄今為止,尚無國產(chǎn)中成藥在美國上市,國產(chǎn)中成藥能否開創(chuàng)歷史,得到FDA的認(rèn)可,仍需要時(shí)間去驗(yàn)證。
相比于中藥現(xiàn)代化領(lǐng)先探索,和黃醫(yī)藥小分子創(chuàng)新藥的出海進(jìn)程相對(duì)順暢。2022年4月底,F(xiàn)DA將對(duì)索凡替尼在美上市進(jìn)行目標(biāo)審評(píng),和黃醫(yī)藥CEO蘇慰國曾對(duì)此表示信心滿滿。今年年初國產(chǎn)PD-1在FDA上市受阻給國內(nèi)醫(yī)藥界敲響了警鐘,不過從當(dāng)時(shí)受阻的原因來對(duì)照,索凡替尼已滿足了多區(qū)域臨床試驗(yàn)以及臨床需求兩項(xiàng)準(zhǔn)則。目前,索凡替尼針對(duì)歐美和中國等地區(qū)開展多項(xiàng)概念驗(yàn)證研究,在此基礎(chǔ)上于美國獲得較好的臨床數(shù)據(jù),并且獲取了FDA快速通道以及孤兒藥等相關(guān)資格認(rèn)證,由此來看索凡替尼FDA在美上市指日可待。
來源:公司年報(bào)、米內(nèi)網(wǎng)新版數(shù)據(jù)庫
注:文中涉及匯率以3月11日計(jì)
如有錯(cuò)漏,敬請(qǐng)指正。



