近日,海思科創(chuàng)新藥研發(fā)迎新進展,HSK16149膠囊申報上市、HSK31858片Ⅱ期臨床試驗獲倫理批準。目前海思科有16個創(chuàng)新藥(13個1類新藥)在研,3款1類新藥上市可期;麻醉新藥快速放量,License-in/out交易并行;23個品種過評(11個為國內首家),8個品種中標國家集采,3個新分類報產品種在審。
13款1類新藥在研,瞄準3大千億市場
11月8日,海思科發(fā)布公告稱,1類新藥HSK16149膠囊上市申請獲國家藥監(jiān)局受理,擬用于周圍性神經(jīng)病理性疼痛的治療。11月16日,海思科發(fā)布公告稱,1類新藥HSK31858片Ⅱ期臨床試驗獲得倫理批準,擬用于治療支氣管擴張癥及急性肺損傷/急性呼吸窘迫綜合征引起的下呼吸道疾病。
海思科以創(chuàng)新藥研發(fā)、生產、銷售為核心業(yè)務,致力于成為最受信賴的國際化創(chuàng)新藥企業(yè)。2022年上半年海思科研發(fā)投入3.47億元,同比增長1.52%,研發(fā)投入占銷售收入的比重為27.82%。
目前海思科在研創(chuàng)新藥有16個(含1類13個、2類3個),聚焦于麻醉及鎮(zhèn)痛、糖尿病及并發(fā)癥、神經(jīng)痛以及腫瘤等疾病領域。米內網(wǎng)數(shù)據(jù)顯示,2021年中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院(簡稱中國公立醫(yī)療機構)終端抗腫瘤和免疫調節(jié)劑、消化系統(tǒng)及代謝藥銷售規(guī)模均超過1700億元,神經(jīng)系統(tǒng)藥物銷售規(guī)模超過1000億元.
海思科主要創(chuàng)新藥情況
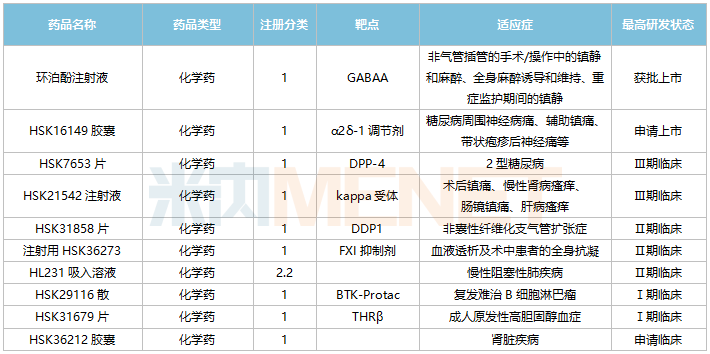
來源:米內網(wǎng)中國臨床試驗庫、公司公告
公司創(chuàng)新研發(fā)管線逐步進入兌現(xiàn)期,目前α2δ-1調節(jié)劑HSK16149膠囊已申報上市;DPP-4抑制劑HSK7653片、kappa受體HSK21542注射液均處于Ⅲ期臨床階段;DPP1抑制劑HSK31858片、FXI抑制劑注射用HSK36273、HL231吸入溶液均處于Ⅱ期臨床階段。
3款1類新藥上市可期!HSK16149膠囊可以與鈣離子通道α2δ亞受體結合,首個申報上市的適應癥為糖尿病周圍神經(jīng)痛,帶狀皰疹后神經(jīng)痛適應癥處于Ⅲ期臨床階段。HSK7653是一款DPP-4長效抑制劑,計劃于2022年底申報NDA,有望成為全球首款降糖藥雙周制劑。HSK21542注射液是鎮(zhèn)痛加止癢雙重作用的外周kappa阿片受體選擇性激動劑,是公司首個國際化的fast follow新藥,開發(fā)適應癥包括術后鎮(zhèn)痛、尿毒癥瘙癢、肝病瘙癢等。
環(huán)泊酚銷售額暴漲!拿下4筆License-in/out交易
環(huán)泊酚注射液是海思科首個進入商業(yè)化階段的1類新藥,也是麻醉領域重磅創(chuàng)新藥,2021年11月獲納入2021版國家醫(yī)保目錄。以獲批上市作為“起點”,環(huán)泊酚注射液適應癥持續(xù)拓展、國際化穩(wěn)步推進,目前在國內已獲批非氣管插管的手術/操作中的鎮(zhèn)靜和麻醉、全身麻醉誘導和維持、重癥監(jiān)護期間的鎮(zhèn)靜等適應癥;在美國直接開展Ⅲ期臨床研究,預計于2023年底申報上市。
適應癥拓展與醫(yī)保助力下,環(huán)泊酚注射液市場迎來快速放量。財報顯示,2022年上半年環(huán)泊酚銷售數(shù)量約150萬支,已進入900多家醫(yī)院,其中三甲以上醫(yī)院占比達55%;力爭全年目標醫(yī)院覆蓋達到1400家左右,全年實現(xiàn)環(huán)泊酚銷售數(shù)量達400萬支以上。令人矚目的是,上半年公司麻醉產品銷售額實現(xiàn)1.29億元,同比增長1602.52%。
除了自研產品的國際化,海思科還積極加強商務發(fā)展,自2021年開始加速推動研發(fā)項目License-out和License-in,優(yōu)化商業(yè)合作充盈產品管線。
License-out方面,海思科海外控股子公司FTP-637項目出售給Foresite Capital,獲得6000萬美元首付款和最高1.2億美元的里程碑付款,彰顯公司研發(fā)實力與產品國際化潛力。FTP-637是一款TYK2抑制劑,全球首款TYK2抑制劑于2022年9月獲FDA批準上市,為百時美施貴寶的氘可來昔替尼。
License-in方面,海思科先后引進美國Starton用于腫瘤化療所致嘔吐的奧氮平透皮貼劑、美國Biosplice長效治療骨關節(jié)炎的Lorecivivint、美國Aquestive治療“漸凍癥”的利魯唑口腔膜。
目前全球暫無奧氮平透皮貼劑獲批上市。米內網(wǎng)數(shù)據(jù)顯示,2021年中國公立醫(yī)療機構終端奧氮平銷售規(guī)模超過20億元,同比增長6.63%;2022年上半年其銷售規(guī)模超過10億元,同比下滑9.66%。利魯唑是FDA批準的第一個漸凍癥藥物,2021年在中國公立醫(yī)療機構終端銷售規(guī)模超過1億元,國內已上市制劑包括利魯唑片、利魯唑膠囊、利魯唑口服混懸液。
23個品種過評,仿制藥管線“收縮”?
仿制藥方面,海思科累計已有22個首仿藥獲批上市。隨著公司向創(chuàng)新藥轉型,仿制藥在研產品逐步減少。2022年至今海思科只提交了格列齊特緩釋片一款仿制藥的上市申請,于7月5日獲CDE承辦。
公司僅剩3個新注冊分類仿制藥上市申請在審,具體為利丙雙卡因乳膏、復方維生素注射液、格列齊特緩釋片,獲批生產后將視同通過一致性評價。隨著仿制藥品種數(shù)量不再新增、存量品種集采消化完畢,公司仿制藥業(yè)務將進入穩(wěn)定發(fā)展狀態(tài)。
目前,海思科已有23個品種通過/視同通過一致性評價。其中,11個品種為國內首家過評,聚普瑞鋅顆粒、復方氨基酸注射液(18AA-Ⅶ)、復方氨基酸(18AA)/葡萄糖(15%)電解質注射液等3個品種為獨家過評。
海思科通過/視同通過一致性評價品種
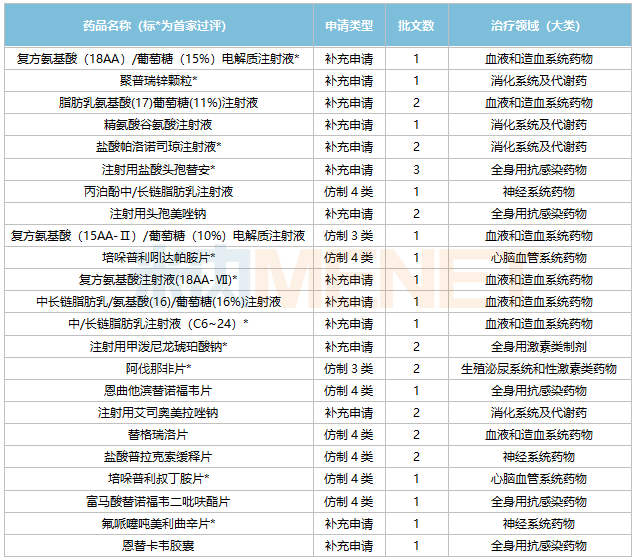
來源:米內網(wǎng)中國申報進度(MED)數(shù)據(jù)庫
從治療領域上看,23個品種主要集中在血液和造血系統(tǒng)藥物(7個)、全身用抗感染藥物(5個)。米內網(wǎng)數(shù)據(jù)顯示,2021年中國公立醫(yī)療機構終端血液和造血系統(tǒng)藥物、全身用抗感染藥物銷售規(guī)模均超過1500億元。
在國家開展的第三、第四批集采中,海思科各有3個品種中標,第七批集采則有2個品種中標,累計8個品種中標國家集采。其中,5個品種以一致性評價補充申請過評,3個品種以新分類注冊批產并視同過評。
一致性評價補充申請方面,海思科還有6個品種在審,包括復方氨基酸注射液(20AA)、注射用醋酸卡泊芬凈、復方氨基酸注射液(18AA-Ⅸ)、磺達肝癸鈉注射液、富馬酸盧帕他定片、復方氨基酸注射液(18AA-Ⅶ)。其中,富馬酸盧帕他定片、復方氨基酸注射液(18AA-IX)沖刺首家過評。
數(shù)據(jù)來源:米內網(wǎng)數(shù)據(jù)庫、公司公告注:米內網(wǎng)《中國公立醫(yī)療機構藥品終端競爭格局》,統(tǒng)計范圍是:中國城市公立醫(yī)院、縣級公立醫(yī)院、城市社區(qū)中心以及鄉(xiāng)鎮(zhèn)衛(wèi)生院,不含民營醫(yī)院、私人診所、村衛(wèi)生室;上述銷售額以產品在終端的平均零售價計算。

