據(jù)紅星新聞報(bào)道,廣東一位母親,向國(guó)家藥監(jiān)局提交信息公開申請(qǐng),希望了解70萬元一針的諾西那生鈉注射液的采購方式和國(guó)內(nèi)定價(jià)依據(jù),引發(fā)網(wǎng)友的關(guān)注和熱議。

該份申請(qǐng)書顯示,歐陽春蘭請(qǐng)求公開引進(jìn)諾西那生鈉注射液的采購合同、國(guó)內(nèi)銷售價(jià)格定價(jià)依據(jù)和定價(jià)計(jì)算相關(guān)說明,以及諾西那生鈉注射液庫存數(shù)量和分配發(fā)放的信息。
70萬一針的諾西那生鈉注射液治療的是什么疾病呢?
據(jù)悉,諾西那生鈉注射液由渤健公司研發(fā),2016年12月23日首次在美國(guó)獲批,是全球首個(gè)脊髓性肌肉萎縮癥精準(zhǔn)靶向治療藥物。隨后,該藥物在歐盟、巴西、日本、韓國(guó)、加拿大等國(guó)家獲得批準(zhǔn)用于治療脊髓性肌肉萎縮癥。
2019年4月28日,諾西那生鈉注射液在中國(guó)上市,用于治療5qSMA,并成為中國(guó)首個(gè)能治療脊髓性肌肉萎縮癥的藥物。
發(fā)病率1/6000-1/10000的嬰幼兒遺傳病
公開資料顯示,脊髓性肌萎縮癥(Spinal Muscular Atrophy,SMA)是一種罕見的遺傳性神經(jīng)肌肉疾病,在新生兒中的發(fā)病率約為 1/6000-1/10000,又被稱為“嬰幼兒遺傳病殺手”。
根據(jù)起病年齡和運(yùn)動(dòng)里程的獲得情況,SAM分為SMA-I型、II型、III型和IV型,如果不進(jìn)行治療,大多數(shù)SMA-I型的患兒無法存活到兩歲。
之所以稱其為罕見病,是因?yàn)檫@種疾病對(duì)于絕大多數(shù)人都是陌生的。賽柏藍(lán)查詢脊髓性肌萎縮癥相關(guān)論文后發(fā)現(xiàn),2016年的一篇文章指出,國(guó)內(nèi)的SMA病患數(shù)量估計(jì)在30000人以上。
在不同的國(guó)家,因?yàn)槿丝诨鶖?shù)等因素的差異,對(duì)罕見病的定義也不盡相同。根據(jù)2002年美國(guó)國(guó)會(huì)通過的《罕見疾病法》,影響美國(guó)20萬人以下的任何疾病或狀況,或平均每1500人中出現(xiàn)1個(gè)病例的疾病可歸類為罕見病。
而歐盟針對(duì)罕見病的定義,還包括了除發(fā)病率以外的其他因素,如“危及生命,或慢性衰弱性疾病,其患病率如此之低,需要共同努力才能攻克的疾病”。
所謂天價(jià),從產(chǎn)業(yè)角度如何理解
公開信息顯示,諾西那生鈉注射液(Spinraza)在美國(guó)的治療費(fèi)用也相當(dāng)昂貴,定價(jià)為12.5萬美元/針,首年需要注射6次,治療費(fèi)用約75萬美元,第二年的費(fèi)用降低一半至37.5萬美元。
目前,諾西那生鈉注射液在國(guó)內(nèi)的售價(jià)為每支69.7萬元,屬于完全自費(fèi)藥物,已創(chuàng)下了中國(guó)藥品售價(jià)的新紀(jì)錄。
就諾西那生鈉注射液的價(jià)格問題,8月5日,國(guó)家醫(yī)保局信訪辦一工作人員表示,諾西那生鈉注射液的價(jià)格是由藥企自行定價(jià),所以該藥在每個(gè)國(guó)家的價(jià)格存在一定出入,“除了藥物的原材料、研發(fā)成本等,藥企也會(huì)考慮利潤(rùn)問題,加上該藥物目前在國(guó)內(nèi)處于市場(chǎng)壟斷的情況,價(jià)格也一直居高不下。”
國(guó)家藥監(jiān)局方面也表示,國(guó)家藥監(jiān)局雖然通過優(yōu)先審評(píng)審批程序批準(zhǔn)使用此藥進(jìn)口用于治療,但其并沒有藥品定價(jià)權(quán)。
如果從藥企的角度看,我們應(yīng)該如何去理解這一價(jià)格呢?
一方面,目前,國(guó)內(nèi)唯一治療脊髓性肌萎縮癥的藥物即為諾西那生鈉注射液,在諾西那生鈉注射液上市之前,這一疾病屬于無藥可治的情況。
另一方面,新藥研發(fā)一直被認(rèn)為是高風(fēng)險(xiǎn)、高收益的活動(dòng),業(yè)內(nèi)一般認(rèn)為,一個(gè)新藥的研發(fā)需要耗時(shí)十年,耗資十億美金。
另外,由于這一藥物治療的還是罕見性疾病,相比于常見的慢性疾病,患病人數(shù)非常少,沒有足夠的患者數(shù)量去攤薄成本,無形中也推高了單個(gè)患者需要支付的價(jià)格。
其實(shí),另外兩種治療SMA的藥物,羅氏的Risdiplam和諾華公司旗下的Zolgensma定價(jià)也非常驚人。
據(jù)共同社消息,Zolgensma在日本的藥價(jià)為1.6707億日元(約合人民幣1102萬元),是日本國(guó)內(nèi)價(jià)格最貴的藥物。
得益于優(yōu)先審評(píng)審批,進(jìn)入中國(guó)
值得注意的是,雖然接近70萬的天價(jià)令人望而卻步,但是也必須看到,得益于相關(guān)部門的一系列努力,新藥在國(guó)內(nèi)上市的速度不斷加快,至少在目前,針對(duì)一些臨床急需的新藥,用得上的問題,已經(jīng)解決了。
2017年12月,原國(guó)家食藥監(jiān)總局發(fā)布《關(guān)于鼓勵(lì)藥品創(chuàng)新實(shí)行優(yōu)先審評(píng)審批的意見》明確提出,將罕見病納入優(yōu)先審評(píng)范圍。
2018年9月,諾西那生鈉注射液作為已在境外上市且臨床急需的罕見病治療新藥被國(guó)家藥監(jiān)局納入優(yōu)先審評(píng)審批程序。
2018年10月31日,國(guó)家藥監(jiān)局會(huì)同國(guó)家衛(wèi)健委發(fā)布《臨床急需境外新藥審評(píng)審批工作程序》及申報(bào)資料要求,建立專門通道對(duì)臨床急需境外上市新藥審評(píng)審批,對(duì)罕見病治療藥品和其他境外新藥分別承諾在3個(gè)月、6個(gè)月內(nèi)審結(jié)。
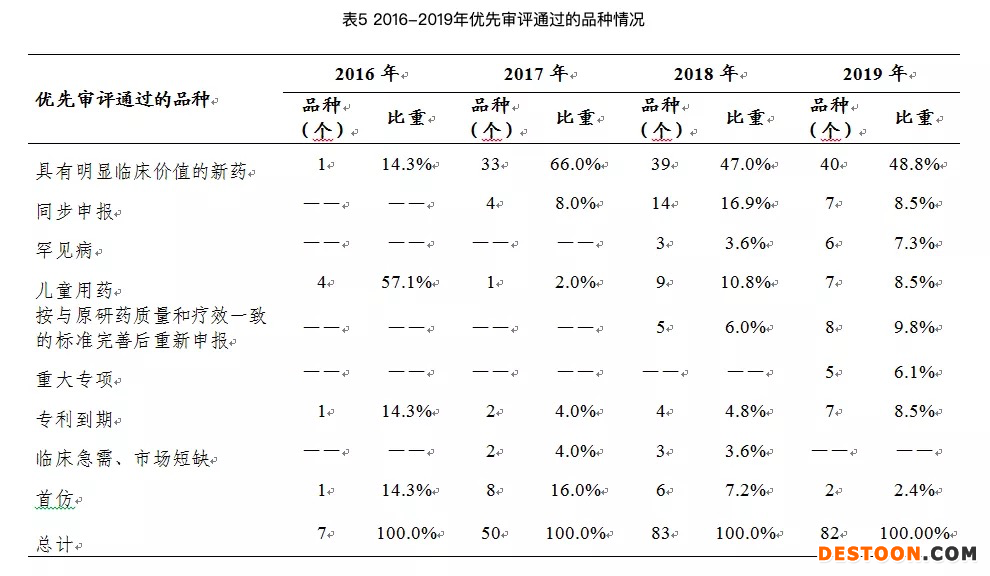
2019年2月,諾西那生鈉注射液通過優(yōu)先審評(píng)審批程序在中國(guó)獲批,2019年4月28日在上海上市。
在日前國(guó)家藥監(jiān)局發(fā)布的《2019年度藥品審評(píng)報(bào)告》中就出現(xiàn)了諾西那生鈉注射液。國(guó)家藥監(jiān)局在審評(píng)報(bào)告中表示,諾西那生鈉注射液的上市有效解決了我國(guó)脊髓性肌萎縮癥目前尚無有效治療手段的臨床用藥急需。
2019年,我國(guó)藥審中心共批準(zhǔn)了16個(gè)用于治療罕見病的、臨床急需的藥品,較2018年增長(zhǎng)了60%,且均在規(guī)定時(shí)限內(nèi)完成審評(píng)工作,大大縮短了臨床急需境外新藥在我國(guó)上市的時(shí)間差距。
用得上之后,還希望用得起
在媒體傳播的信息中,有一組看似對(duì)比鮮明的數(shù)字刺痛了部分網(wǎng)友的神經(jīng)——41澳元和70萬人民幣。但實(shí)際上,這兩個(gè)數(shù)字背后是兩個(gè)不同的概念。
渤健生物在今日發(fā)表的聲明中指出,藥品價(jià)格和藥品報(bào)銷后患者自付費(fèi)用,是兩個(gè)完全不同的概念。
據(jù)澳大利亞藥品福利計(jì)劃(The Pharmaceutical Benefit Scheme - PBS)網(wǎng)站的公開信息,諾西那生鈉注射液已被納入藥品福利計(jì)劃,藥品的政府采購單支價(jià)格為11萬澳元,患者自付費(fèi)用為41澳元。41澳元不是諾西那生鈉注射液在澳大利亞的藥品價(jià)格。
截至2020年6月30日,諾西那生鈉注射液已在全球50個(gè)國(guó)家和地區(qū)獲批,并在40多個(gè)國(guó)家和地區(qū)獲得了報(bào)銷,包括澳大利亞。
在中國(guó),諾西那生鈉注射液還不是醫(yī)保藥品。根據(jù)國(guó)家相關(guān)規(guī)定,參加2019年國(guó)家醫(yī)保談判的藥品必須是2018年12月31日前獲得批準(zhǔn)的藥品。諾西那生鈉注射液于2019年2月獲批,不符合參加2019年國(guó)家醫(yī)保談判的條件,因此并未參加2019年國(guó)家醫(yī)保談判。
渤健生物表示,針對(duì)SMA患者,其已經(jīng)開展了一些援助捐贈(zèng)活動(dòng)——2019年5月31日,中國(guó)初級(jí)衛(wèi)生保健基金會(huì)宣布SMA患者援助項(xiàng)目正式啟動(dòng),援助藥物由渤健公司捐贈(zèng)——該項(xiàng)目幫助SMA患者第一年的治療費(fèi)用相比全自費(fèi)節(jié)省約2/3,之后每年的治療費(fèi)用與全自費(fèi)相比可節(jié)省約一半。
截至目前,全國(guó)已有80多位SMA患者在援助項(xiàng)目的幫助下獲得了藥物治療。
同時(shí),渤健生物也一直與國(guó)家和地方政府相關(guān)部門保持積極溝通,呼吁建立多方共付機(jī)制,以進(jìn)一步提升中國(guó)SMA患者藥物可及性。
在去年的國(guó)家醫(yī)保談判中,150個(gè)藥品,最終97個(gè)談判成功并被全部納入醫(yī)保目錄乙類藥品范圍。一批認(rèn)可度高、新上市且臨床價(jià)值高的藥品,如癌癥、罕見病、慢性疾病用藥以及兒童用藥調(diào)入目錄。
國(guó)家醫(yī)保局方面也表示,后續(xù)會(huì)探索建立醫(yī)保目錄動(dòng)態(tài)調(diào)整機(jī)制,綜合臨床需求、醫(yī)?;鸪惺芰?strong>企業(yè)的價(jià)格意愿,再次開展價(jià)格談判,將合適的藥品納入醫(yī)保目錄。
應(yīng)該說,國(guó)家醫(yī)保談判,一方面釋放了支持創(chuàng)新藥的明確信號(hào),另一方面也使得貴族藥變平民藥,極大減輕了患者的負(fù)擔(dān)。
但是也必須看到,我國(guó)人口眾多,疾病類型復(fù)雜多樣,隨著人口老齡化的加速,醫(yī)?;鸬闹Ц赌芰σ裁媾R挑戰(zhàn),在有限的盤子之下,判斷哪些群體的用藥和健康需求應(yīng)該得到保障,其實(shí)并不是一個(gè)容易的問題。
來源:醫(yī)藥網(wǎng)
來源:醫(yī)藥網(wǎng)



 110102000668(1)號(hào)
110102000668(1)號(hào)