中國醫(yī)藥化工網(wǎng)訊 近日,黑龍江省食藥監(jiān)局發(fā)布《收回藥品GMP證書公告(2016年第02號)》,兩藥企被收回GMP證書。
值得注意的是,被收GMP的這兩家藥企,均為中藥飲片生產(chǎn)企業(yè)。而且,兩家藥企均是被投訴舉報而遭此橫禍。
中藥飲片企業(yè)頻被收證
在近日各省接二連三發(fā)布的收回GMP公告中,亦是已中藥飲片企業(yè)居多。據(jù)不完全統(tǒng)計,4月底至今,不到一個月的時間,已有9家藥企被收回GMP證書,其中有7家為中藥飲片企業(yè)。
中藥飲片企業(yè)被收GMP的公告頻出,結(jié)合前兩年被收回GMP的企業(yè)來看,可以發(fā)現(xiàn),中藥飲片成為“收證”重災(zāi)區(qū)的形勢并未改變??梢?,各省藥監(jiān)部門已經(jīng)明顯加強對中藥飲片生產(chǎn)及流通的整治,我們也可以預(yù)見,中藥飲片企業(yè)淘汰賽已經(jīng)拉響。
舉報橫行,藥企屢屢遭罰
上文提到,黑龍江近日收回GMP的兩家藥企,是投訴舉報的功勞。
近年來,飛檢對于藥企而言可以說已經(jīng)是家常便飯了。而飛檢的力度大家也心知肚明。然而,誰也沒有想到,到了2016年,舉報橫空出世,成了飛檢的一大功臣。藥企因舉報被收回GMP或者GMP認(rèn)證不通過的例子,迄今為止已經(jīng)有超過10家藥企因投訴舉報被飛檢,遭受嚴(yán)厲處罰。
從舉報的成果來看,讓我們佩服的是,群眾舉報威力實在太大,簡直是一舉報一個準(zhǔn)。眾多舉報的群眾中,當(dāng)然也可能包括業(yè)內(nèi)的同行或競爭對手。
有了投訴舉報這一招后,未來通過GMP認(rèn)證和在未來監(jiān)管中,恐怕是要遭受更加嚴(yán)格檢查了。
為何中藥飲片企業(yè)屢屢中招?
據(jù)報告分析,截至2015年上半年,全國中藥飲片生產(chǎn)企業(yè)有972家,雖然數(shù)量眾多,但行業(yè)集中度較低,企業(yè)間競爭日趨激烈。中藥飲片生產(chǎn)企業(yè)普遍規(guī)模偏小,小型企業(yè)占絕大多數(shù)。
被收回GMP證書中藥飲片企業(yè),將面臨停產(chǎn)、產(chǎn)品召回等諸多問題。如果經(jīng)歷多次認(rèn)證仍未成功,其還將面臨被收購,甚至破產(chǎn)關(guān)閉的局面。這也是近年來藥監(jiān)部門對于中藥飲片企業(yè)瘋狂收證后想要看到的局面。
藥監(jiān)部門在嚴(yán)格要求中藥飲片生產(chǎn)企業(yè)的同時,鼓勵其進(jìn)行兼并重組,部分規(guī)模小、競爭力較弱、管理不規(guī)范的生產(chǎn)企業(yè)將逐步被市場所淘汰。隨著行業(yè)的不斷發(fā)展和優(yōu)勢企業(yè)競爭力的提升,中藥飲片行業(yè)集中度也將逐步提高。



以下是近期被收GMP證書藥企的匯總:
黑龍江省
黑龍江省收回藥品GMP證書公告(2016年第02號)
黑龍江鶴祥春中藥飲片有限公司、哈爾濱宇泰藥業(yè)有限公司嚴(yán)重違反《藥品生產(chǎn)質(zhì)量管理規(guī)范》規(guī)定,依據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范認(rèn)證管理辦法》第三十三條規(guī)定,我局依法收回其《藥品GMP證書》,現(xiàn)予以公布。

檢查發(fā)現(xiàn)問題:
黑龍江鶴祥春中藥飲片有限公司:
一、檢驗設(shè)備不能滿足所生產(chǎn)的中藥飲片全檢要求。
如液相色譜儀缺少黃芪飲片檢驗使用的蒸發(fā)光檢測器,現(xiàn)場未見生物顯微鏡;
二、涉嫌編造檢驗記錄。
(一)批號為150601和150604柴胡飲片含量檢驗數(shù)據(jù)完全一致;黃芪、黃芩、刺五加藥材與飲片檢驗數(shù)據(jù)完全一致;
?。ǘ┢髽I(yè)生產(chǎn)的刺五加、黃芪、黃芩、柴胡等中藥飲片檢驗記錄中沒有相應(yīng)的中藥材和中藥飲片檢驗圖譜;
?。ㄈ┰谄髽I(yè)化驗室未見有生產(chǎn)中藥飲片的對照品、對照藥材,現(xiàn)場看到的黃芩苷對照品溶液、柴胡皂苷a、d混合液未標(biāo)示配制日期;
三、留樣管理混亂。
2015年生產(chǎn)的柴胡、羌活、藁本、赤芍、白鮮皮、板藍(lán)根、防風(fēng)、橘核、黃芪、黃芩、刺五加中藥飲片沒有留樣;百合、地黃留樣無留樣標(biāo)識;
四、生產(chǎn)的部分品種未進(jìn)行工藝驗證。
哈爾濱宇泰藥業(yè)有限公司:
一、藥材和飲片未按規(guī)定檢驗。檢查企業(yè)檢驗用對照品及其臺賬,沒有部分對照品和對照藥材,但檢驗報告中出具了檢驗結(jié)果;
二、物料管理混亂,入庫、發(fā)放不可追溯。部分中藥材如夏枯草包裝袋已破損,地面灑落大量藥材;多數(shù)物料均無相應(yīng)貨位卡;許多藥材外包裝無任何標(biāo)識信息;原料庫內(nèi)標(biāo)識劃分不清,不能有效區(qū)分合格區(qū)和待驗區(qū);部分藥材沒有保管賬;
三、成品未按規(guī)定放行,出庫不可追溯。企業(yè)成品庫內(nèi)大部分品種貨位卡與實際庫存數(shù)量不符,貨位卡上沒有產(chǎn)品出庫過程,成品庫房沒有成品審核放行單和檢驗報告單;
四、企業(yè)未建立銷售記錄;
五、部分生產(chǎn)品種未進(jìn)行工藝驗證。
廣西壯族自治區(qū)
收回藥品GMP證書公告(2016年第1號)
廣西匯粹藥業(yè)有限公司因嚴(yán)重違反《藥品生產(chǎn)質(zhì)量管理規(guī)范》規(guī)定,依據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范認(rèn)證管理辦法》第三十三條規(guī)定,我局依法收回其《藥品GMP證書》,現(xiàn)予以公布。

涉嫌違法違規(guī)行為:
一、對部分原藥材入廠未按規(guī)定進(jìn)行檢驗。如桔梗(批號:150601)、金銀花(批號:150801)、陳皮(批號:150601)、山銀花(批號:160101)等原藥材的含量測定。
二、對部分成品未按規(guī)定全檢即銷售。如天麻(批號:20151201)、大黃(批號:20150201)、炙甘草(批號:20150601)的含量測定;甘草(批號:20150601)的重金屬及有害元素、有機氯農(nóng)藥殘留量等的檢驗。
三、購進(jìn)中藥飲片直接分裝銷售。從廣西益生堂藥業(yè)有限公司購進(jìn)甘草切片(批號:20150501)(圓片或斜片)直接分裝銷售。
四、批生產(chǎn)記錄不真實,編造生產(chǎn)記錄。如批號為20150801(規(guī)格:圓片,包裝規(guī)格:0.5kg/袋和1kg/袋)、20150501(規(guī)格:圓片,包裝規(guī)格:0.2kg/罐)等多批次的甘草批生產(chǎn)記錄,以及批號為20150601(規(guī)格,圓片,包裝規(guī)格:0.5kg/袋和2kg/袋)、20150701(規(guī)格,斜片,包裝規(guī)格:0.5kg/袋)等多批次的炙甘草批生產(chǎn)記錄,批號為20150501、20150601(規(guī)格:段)的丹參批生產(chǎn)記錄等,這些產(chǎn)品都是以切片為起始原料,但其批生產(chǎn)記錄中也編上有凈選、洗潤、切制等藥材加工操作崗位記錄,且記錄中所有工序涉及有關(guān)人員的簽名都不是其本人簽署。
五、偽造檢驗報告書。如批號為20150601的甘草(規(guī)格:圓片)有2份成品檢驗報告書(產(chǎn)量不一致);批號為20150901的金銀花中重金屬和有害元素的項目未檢驗,但成品檢驗報告書上顯示重金屬和有害元素符合規(guī)定。
六、質(zhì)量管理混亂,質(zhì)量保證體系未能有效運行,放行審核形同虛設(shè)。企業(yè)的質(zhì)量受權(quán)人沒有認(rèn)真履行成品質(zhì)量審核職責(zé),如批號為20150601的甘草(規(guī)格:圓片)、批號為20150601的炙甘草、批號為20150501、20150601的丹參等的放行審核沒有經(jīng)質(zhì)量受權(quán)人唐昌審核,《成品審核放行單》上審核人“黃有麗”、質(zhì)量部經(jīng)理“唐昌”的簽名,均不是其本人簽署。
廣西收回藥品GMP證書公告(2016年第2號)
廣西圣民制藥有限公司因嚴(yán)重違反《藥品生產(chǎn)質(zhì)量管理規(guī)范》規(guī)定,依據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范認(rèn)證管理辦法》第三十三條規(guī)定,我局依法收回其《藥品GMP證書》,現(xiàn)予以公布。

涉嫌違法違規(guī)行為:
一、生產(chǎn)所用的原料無法追溯
(一)提取車間所使用的中藥材來源不明。銀翹解毒顆粒(批號160301)于2016年3月4日由提取車間使用薄荷、荊芥、連翹、金銀花、桔梗、淡竹葉、甘草、淡豆豉、牛蒡子(炒)等9味原料進(jìn)行投料生產(chǎn),而倉庫的臺帳、貨位卡上均無上述原料的出庫記錄,倉庫內(nèi)也沒有留存有相應(yīng)的領(lǐng)料單,除了連翹、淡竹葉、甘草外,薄荷、荊芥、金銀花、桔梗、淡豆豉、牛蒡子(炒)等6 味原料在2016年1月31日前已經(jīng)沒有庫存;黃芩片(批號160301)于2016年2月19日由提取車間使用黃芩3350kg進(jìn)行投料生產(chǎn),而中藥材倉庫的臺帳、貨位卡上均無黃芩的出庫記錄,倉庫內(nèi)也沒有留存有黃芩的領(lǐng)料單。
(二)批生產(chǎn)記錄中沒有標(biāo)明中藥材的批號。銀翹解毒顆粒(批號160301)、黃芩片(批號160301)的批生產(chǎn)記錄中對所使用的中藥材均沒有標(biāo)明批號。
二、編造批生產(chǎn)記錄
(一)批生產(chǎn)記錄的投料量與實際產(chǎn)量嚴(yán)重不符。銀翹解毒顆粒(批號160301)批生產(chǎn)記錄的投料總數(shù)為5萬袋(每袋15g),而潔凈區(qū)的顆粒干燥間、暫存間、分裝間共存放有銀翹解毒顆粒(批號160301)84桶(每桶28kg,共計2352kg,可分裝成15.68萬袋),外包間存放有已完成中包裝工序的銀翹解毒顆粒(批號160301)120件(每件15g×10袋×120盒,共計14.4萬袋),產(chǎn)量總計30.08萬袋;黃芩片(批號160301)批生產(chǎn)記錄投料總數(shù)為100萬片,而潔凈區(qū)中間體暫存間存放有黃芩素片(批號160301,片重0.25g)16桶(每桶50kg,共計800 kg、320萬片)、黃芩片顆粒(批號160301)12桶(每桶85kg,共1020Kg,可壓片408萬片),壓片間存放有黃芩片顆粒(批號160301)5桶(每桶85kg,共425Kg,可壓片170萬片),產(chǎn)量總計898萬片。
(二)提前設(shè)定成品數(shù)量。銀翹解毒顆粒(批號160301)的內(nèi)分工序尚未全部完成,而批生產(chǎn)記錄上已標(biāo)明“成品數(shù)量:41件28盒”;黃芩片(批號160301)尚未開始包糖衣,而批生產(chǎn)記錄上已標(biāo)明“成品數(shù)量:27件5大盒(入庫)”。
廣東省
4月29日,廣東省食藥監(jiān)局發(fā)布了2016年第5號飛行檢查通報,深圳市東江制藥有限公司因存在嚴(yán)重缺陷4項,主要缺陷4項,被收回GMP證書。
具體信息如下:
企業(yè)名稱:深圳市東江制藥有限公司
生產(chǎn)地址:深圳市龍崗區(qū)平湖街道山廈路71號園區(qū)1棟廠房
檢查單位:深圳市食品藥品監(jiān)管局
檢查日期:2016年4月7日
事由:日常監(jiān)督檢查
檢查發(fā)現(xiàn)的主要問題
中藥飲片生產(chǎn)不符合藥品GMP要求,存在嚴(yán)重缺陷4項,主要缺陷4項。嚴(yán)重缺陷摘要如下:
一、編造檢驗記錄。兩個檢驗員于2015年10月入職,但該兩名人員在2015年9月26日、27日的大黃素對照品使用記錄上簽名。
二、物料管理混亂。生產(chǎn)車間(篩選間)、中間產(chǎn)品庫、退貨區(qū)、冷庫、藥材常溫庫放置的藥材及中間產(chǎn)品無物料標(biāo)識。
三、批生產(chǎn)記錄不完整,不具可追溯性。151201批制何首烏、151201批酒蓯蓉的篩選工序、內(nèi)包裝工序、標(biāo)簽打印使用記錄為空白,切制、烘干、蒸制等工序為鉛筆填寫。
四、產(chǎn)品放行不符合規(guī)范要求。未經(jīng)審核,151201批制何首烏、151201批酒蓯蓉已出庫;151101批天麻于2015年12月6日經(jīng)質(zhì)量受權(quán)人簽字同意放行,現(xiàn)場檢查時篩選間正在進(jìn)行該批產(chǎn)品的貼簽操作,現(xiàn)場未能提供生產(chǎn)記錄。
處理措施
一、鑒于深圳市東江制藥有限公司不符合藥品GMP要求,根據(jù)藥品GMP管理的有關(guān)規(guī)定,省局決定收回該公司中藥飲片(凈制、切制、蒸制、炒制、炙制)的《藥品GMP證書》(證書編號GD20150382)。
二、要求深圳市食品藥品監(jiān)管局督促企業(yè)改正,并加強日常監(jiān)管工作。
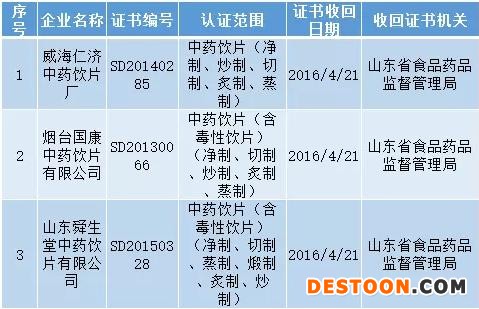
山東省
威海仁濟(jì)中藥飲片廠等3家藥品生產(chǎn)企業(yè)嚴(yán)重違反《藥品生產(chǎn)質(zhì)量管理規(guī)范》規(guī)定,依據(jù)《藥品生產(chǎn)質(zhì)量管理規(guī)范認(rèn)證管理辦法》第三十三條規(guī)定,我局依法收回其《藥品GMP證書》,現(xiàn)予以公告。

安徽省
4月25日,安徽省食藥監(jiān)局發(fā)布了《安徽省食品藥品監(jiān)督管理局關(guān)于收回安徽艾珂爾制藥有限公司藥品GMP證書的批復(fù)》,同意滁州市食品藥品監(jiān)督管理局《關(guān)于建議收回安徽艾珂爾制藥有限公司藥品GMP認(rèn)證證書的請示》,經(jīng)研究,現(xiàn)批復(fù)如下:
一、同意收回安徽艾珂爾制藥有限公司《藥品GMP證書》(編號為:AH20150215和AH20150216)。
二、責(zé)成你局對該企業(yè)違反《藥品管理法》、《藥品生產(chǎn)質(zhì)量管理規(guī)范》的行為進(jìn)行依法查處,立即召回已銷售的“萘敏維滴眼液”產(chǎn)品,對庫存“萘敏維滴眼液”產(chǎn)品進(jìn)行查封。
三、請你局約談該企業(yè),監(jiān)督企業(yè)按照藥品GMP要求進(jìn)行全面整改,
請你局接文后,立即通知該企業(yè)上繳藥品GMP證書,并于一周內(nèi)送交省局。查處、召回和監(jiān)督整改情況請于5月底前報省局。



 110102000668(1)號
110102000668(1)號