2月24日訊 2月3日,拜耳在華正式提交糖尿病腎病治療藥finerenone(BAY94-8862)上市申請,此前大規(guī)模III期臨床試驗(yàn)陽性結(jié)果獲得國際頂級學(xué)術(shù)期刊發(fā)表,引起業(yè)內(nèi)廣泛關(guān)注。糖尿病,作為嚴(yán)重影響人類生命健康的三大慢病之一,一直以來都是盛產(chǎn)重磅藥品的溫床。我國是糖尿病人口第一大國,糖尿病患病人數(shù)超過一億且還在不斷快速增長,但受制于經(jīng)濟(jì)發(fā)展水平,居民糖尿病知曉率、治療率、控制率低,用藥結(jié)構(gòu)與發(fā)達(dá)國家存在一定的代差。隨著國民健康意識(shí)的普遍提升,以及醫(yī)保制度的不斷完善,國內(nèi)糖尿病治療市場擴(kuò)容結(jié)構(gòu)升級,機(jī)遇廣闊,自然成為國內(nèi)外各大制藥公司研發(fā)投入的重點(diǎn)。以下讓我們來看一看國內(nèi)糖尿病領(lǐng)域最近取得的一些新進(jìn)展。
新近獲批:首仿藥大舉進(jìn)入沖擊原研市場
新藥方面,2020年7月,輝瑞及默沙東聯(lián)合開發(fā)的SGLT-2抑制劑艾托格列凈在國內(nèi)獲批上市,成為繼達(dá)格列凈、恩格列凈和卡格列凈之后國內(nèi)批準(zhǔn)的第4款SGLT-2抑制劑。獲批上市僅半年之后,艾托格列凈醫(yī)保談判成功,正式列入2020版國家醫(yī)保目錄,和之前上市的3款SGLT-2抑制劑站在了同一起跑線上。
仿制藥方面,二肽基肽酶-4(DDP4)抑制劑及其與二甲雙胍的二聯(lián)復(fù)方成為研發(fā)競賽的主戰(zhàn)場。2020年以來,已有2個(gè)DDP4抑制劑單方和3個(gè)與二甲雙胍配伍的二聯(lián)復(fù)方國產(chǎn)首仿藥獲批上市,近30億進(jìn)口藥壟斷市場有望被打破。DPP-4抑制劑憑借其對體質(zhì)量無影響、低血糖發(fā)生率低、可口服等顯著特點(diǎn),在國內(nèi)外臨床指南中逐步得到充分認(rèn)可,治療地位不斷提升,隨著我國醫(yī)保目錄覆蓋品種范圍的擴(kuò)大,市場份額有望進(jìn)一步提升。
糖尿病治療領(lǐng)域近期獲批上市的首仿藥
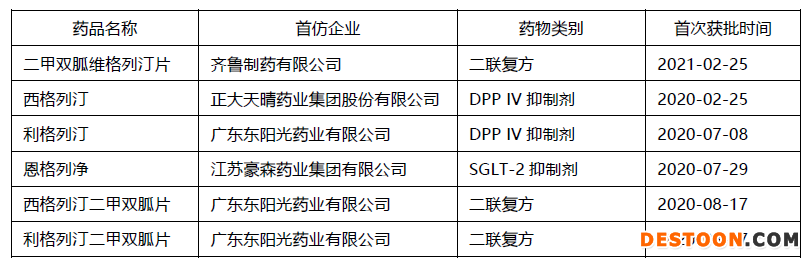
數(shù)據(jù)來源:CPM新藥研發(fā)監(jiān)測數(shù)據(jù)庫
NDA審評中:進(jìn)口原研和國產(chǎn)原創(chuàng)平分秋色
對于原創(chuàng)性新藥來說,提交上市申請屬于研發(fā)進(jìn)程中的重要里程碑事件。在歷經(jīng)近5年的時(shí)間,完成納入全球48個(gè)國家1000多個(gè)中心5734例慢性腎病合并2型糖尿病(T2DM)患者的Ⅲ期臨床試驗(yàn)之后,拜耳先后于去年年底及今年年初在美國、歐盟、中國等地向藥品監(jiān)管當(dāng)局提交了finerenone上市申請,目前在美國已獲優(yōu)先審評資格。
除了finerenone以外,在中國市場處于NDA上市審評階段的糖尿病治療藥物還有5款,3款屬于國產(chǎn)一類原創(chuàng)新藥,兩款為進(jìn)口原研品種。其中申報(bào)時(shí)間相對較早的諾和諾德原研GLP-1類似物司美魯肽,已完成一輪資料補(bǔ)充,在1月底離開審評隊(duì)列,不出意外地話預(yù)計(jì)將很快獲批上市。2019年申報(bào)上市的微芯藥業(yè)原創(chuàng)新藥西格列他鈉片和田邊三菱的原研進(jìn)口品種氫溴酸替格列汀片,目前處于第一輪補(bǔ)充資料排隊(duì)審評中,恒瑞醫(yī)藥去年下半年申報(bào)上市的兩款一類新藥恒格列凈和瑞格列汀,目前尚處于新報(bào)任務(wù)排隊(duì)序列中。曾于2015年申報(bào)上市后又撤回的瑞格列汀能否彎道超車,早于微芯藥業(yè)的西格列他通過審評,成為口服降糖藥領(lǐng)域首個(gè)成功上市的自主創(chuàng)新一類新藥,讓我們拭目以待!
糖尿病治療領(lǐng)域處于上市審評階段創(chuàng)新藥
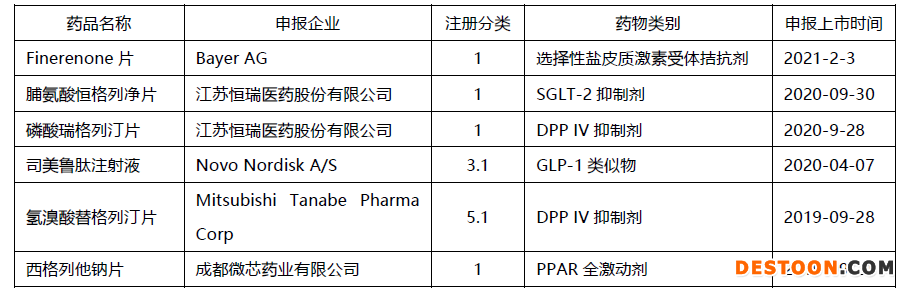
數(shù)據(jù)來源:CPM新藥研發(fā)監(jiān)測數(shù)據(jù)庫



