4月26日訊 去年一年,有84888 家次藥店被查處。新一輪檢查已開始,零售藥店千萬別碰這5大雷區(qū)。
檢查299.5萬家次,84888家次藥店被罰
根據國家藥監(jiān)局最新公布的《藥品監(jiān)督管理統(tǒng)計年度報告(2020年)》,2020年各級監(jiān)管機構共檢查藥品經營企業(yè)304.25萬家次。
其中, 檢查批發(fā)企業(yè) 4.75 萬家次,發(fā)現存在違反藥品經營相關管理規(guī)定行為的企業(yè) 5855 家次,完成整改 6451 家次。檢查零售企業(yè)299.5萬家次,發(fā)現存在違反藥品經營相關管理規(guī)定行為的企業(yè) 8.49 萬家次,完成整改9.18萬家次。
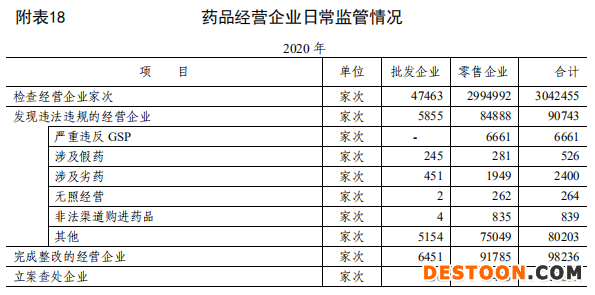
梳理發(fā)現,在 84888 家次藥品零售企業(yè)中,有6661家次藥店被查處的原因是嚴重違反GSP,281家次原因是涉及假藥,1949家次原因是涉及劣藥,262家次原因是涉及無照經營,還有835家次涉及非法渠道購進藥品。
5類違法行為,嚴查重罰
對于嚴重違反GSP、零售假藥、零售劣藥、無照經營、非法渠道購進藥品等5類違法行為,筆者重點提醒,按照新版《藥品管理法》,一旦涉及這些違法行為,都將被重罰。
1、嚴重違反GSP,最高可罰200萬元:藥品經營企業(yè)未遵守藥品經營質量管理規(guī)范的,責令限期改正,給予警告;逾期不改正的,處十萬元以上五十萬元以下的罰款;情節(jié)嚴重的,處五十萬元以上二百萬元以下的罰款,責令停產停業(yè)整頓直至吊銷藥品經營許可證。
2、零售假藥,最低罰款150萬元:銷售假藥的,沒收違法銷售的藥品和違法所得,責令停產停業(yè)整頓,吊銷藥品批準證明文件,并處違法銷售的藥品貨值金額十五倍以上三十倍以下的罰款;貨值金額不足十萬元的,按十萬元計算;情節(jié)嚴重的,吊銷藥品經營許可證,十年內不受理其相應申請。
3、零售劣藥,最低罰款10萬元:銷售劣藥的,沒收違法銷售的藥品和違法所得,并處違法銷售的藥品貨值金額十倍以上二十倍以下的罰款;違法零售的藥品貨值金額不足一萬元的,按一萬元計算;情節(jié)嚴重的,責令停產停業(yè)整頓直至吊銷藥品經營許可證。銷售的中藥飲片不符合藥品標準,尚不影響安全性、有效性的,責令限期改正,給予警告;可以處十萬元以上五十萬元以下的罰款。
4、無照經營,最低罰款150萬元:未取得藥品經營許可證銷售藥品的,責令關閉,沒收違法生產、銷售的藥品和違法所得,并處違法生產、銷售的藥品(包括已售出和未售出的藥品,下同)貨值金額十五倍以上三十倍以下的罰款;貨值金額不足十萬元的,按十萬元計算。
5、非法渠道購進藥品,最低罰款10萬元:違反本法規(guī)定,藥品經營企業(yè)未從藥品上市許可持有人或者具有藥品生產、經營資格的企業(yè)購進藥品的,責令改正,沒收違法購進的藥品和違法所得,并處違法購進藥品貨值金額二倍以上十倍以下的罰款;情節(jié)嚴重的,并處貨值金額十倍以上三十倍以下的罰款,吊銷藥品經營許可證;貨值金額不足五萬元的,按五萬元計算。
零售藥店,新的檢查來了
按照國家藥監(jiān)局綜合司《關于開展藥品流通環(huán)節(jié)專項檢查工作的通知》(藥監(jiān)綜藥管〔2021〕35號)和《關于開展醫(yī)療器械質量安全風險隱患排查治理工作的通知》,北京、山東、寧夏、浙江、山西、安徽等地接連公布了2021年藥品、醫(yī)療器械監(jiān)管工作要點。
以北京為例,本月20日該市藥監(jiān)局召開了藥品醫(yī)療器械監(jiān)管重點工作及質量安全排查部署會。會議宣布,從即日起到年底,北京市將開展為期8個月的藥品、醫(yī)療器械質量安全大檢查。此次檢查治理重點包括疫情防控類醫(yī)療器械、集中帶量采購中選產品、無菌和植入性醫(yī)療器械、網絡銷售醫(yī)療器械。
根據各地藥監(jiān)部門發(fā)布的文件,賽柏藍—藥店經理人梳理了10項整治重點,零售藥店這些行為千萬別碰。
1、藥品購銷渠道檢查。重點檢查企業(yè)藥品購銷存記錄、票據、憑證,是否存在非法回收或參與非法回收藥品、銷售回收藥品以及非法購進醫(yī)療機構制劑并銷售等行為。
2、執(zhí)業(yè)藥師配備情況檢查。檢查零售藥店是否按要求配備執(zhí)業(yè)藥師(或藥學技術人員)以及是否在崗執(zhí)業(yè)等情況。
3、處方藥銷售情況檢查。重點檢查是否存在未按規(guī)定銷售含特殊藥品復方制劑、銷售疫苗、麻醉藥品、第一類精神藥品、藥品類易制毒化學品、終止妊娠藥品、中藥配方顆粒等國家明令禁止零售的藥品等行為。
4、藥品網絡銷售違法違規(guī)行為檢查。重點查未取得資質開展藥品網絡銷售問題、藥品網絡銷售者通過網絡違法違規(guī)銷售藥品問題以及網絡交易服務第三方平臺履責問題。
5、重點品種(疫苗、特殊管理藥品、血液制品、國家集中采購藥品)的追溯體系是否完整。
6、涉及假劣藥的質量風險控制(經營范圍、藥品效期的自動控制、近效期藥品庫存管理等),藥品包裝、性狀的檢查是否嚴格按GSP的要求進行操作。
7、企業(yè)冷鏈藥品管理情況,藥品儲存運輸記錄是否完整、 真實;是否未按規(guī)定對藥品儲存、運輸、進行溫濕度監(jiān)測;冷庫、冷藏車溫濕度數據是否能實時上傳。
8、是否在核準地址以外的場所儲存藥品;是否擅自改變注冊地址、經營方式、經營范圍銷售藥品。是否超經營范圍銷售藥品。
9、是否未按規(guī)定對藥品儲存、運輸、進行溫濕度監(jiān)測、篡改計算機系統(tǒng)、溫濕度監(jiān)測系統(tǒng)數據,隱瞞真實藥品購銷存記錄、票據、憑證、數據。
10、重點排查新冠病毒檢測試劑、呼吸機、醫(yī)用防護服、醫(yī)用口罩和紅外體溫計等疫情防控醫(yī)療器械,特別是應急審批投產、跨界轉產的企業(yè),以及產品質量不合格、質量體系有缺陷等企業(yè)。



