據(jù)不完全統(tǒng)計(jì),今年上半年有39款新藥在我國獲批上市(不含中藥與疫苗類產(chǎn)品),其中包括23款首次獲批的新藥,以及16款獲批新適應(yīng)癥的產(chǎn)品。隨著國家藥品監(jiān)督管理局優(yōu)先審評(píng)審批制度的實(shí)施,不少產(chǎn)品審評(píng)審批速度加快,與上年同期相比,臨床急需境外新藥獲批數(shù)量有所增加。
生物藥領(lǐng)域迎來首款A(yù)DC藥物
在今年上半年批準(zhǔn)的39款新藥中,21款為生物制劑(包括16款抗體藥物),18款為小分子化藥。按首次批準(zhǔn)計(jì)算,上半年批準(zhǔn)了10款生物藥,多為進(jìn)口產(chǎn)品。武田、羅氏、賽諾菲和協(xié)和發(fā)酵麒麟株式會(huì)社各有2款生物藥獲批(詳見表1)。
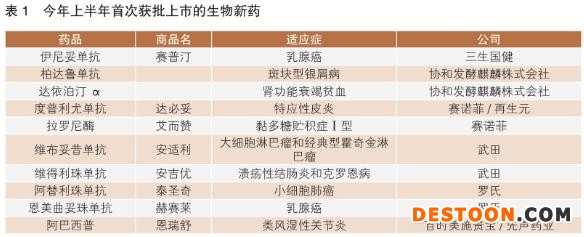
近年來,不少新藥研發(fā)公司持續(xù)投入生物藥開發(fā),創(chuàng)新產(chǎn)品相繼獲批上市,來自全球大型醫(yī)藥企業(yè)的創(chuàng)新生物藥產(chǎn)品為我國患者帶來更多治療選擇。
值得一提的是,今年1月我國首次批準(zhǔn)了抗體偶聯(lián)藥物(ADC)恩美曲妥珠單抗上市——單藥用于HER2陽性早期乳腺癌患者的輔助治療。4個(gè)月后,國家藥監(jiān)局批準(zhǔn)了第二款A(yù)DC藥物維布妥昔單抗,用于大細(xì)胞淋巴瘤(sALCL)和霍奇金淋巴瘤(cHL)的治療。
事實(shí)上,ADC藥物開發(fā)并非一帆風(fēng)順。過去幾十年中,業(yè)界投入大量資源和精力改進(jìn)構(gòu)建ADC技術(shù),有效提高了ADC藥物的獲益/風(fēng)險(xiǎn)比。目前,全球已有8款A(yù)DC藥物獲批上市。此次國家藥監(jiān)局批準(zhǔn)恩美曲妥珠單抗和維布妥昔單抗上市,意味著ADC這種創(chuàng)新療法已在我國落地。
修美樂、PD-1“豐收”新適應(yīng)癥
每一款藥物的成功獲批都是科學(xué)家多年努力的成果,來之不易。如果它能擴(kuò)展更多適應(yīng)癥,則意味著將有機(jī)會(huì)造福更多患者。
從今年上半年我國藥品審評(píng)審批情況來看,至少有16款創(chuàng)新藥產(chǎn)品獲得了新適應(yīng)癥批準(zhǔn),其中5款為小分子化藥獲批新適應(yīng)癥。如諾華的黑色素瘤聯(lián)合療法曲美替尼和達(dá)拉非尼、入局ALK陽性局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌一線治療的塞瑞替尼,以及勃林格殷格翰獲批系統(tǒng)性硬化病相關(guān)間質(zhì)性肺?。⊿Sc-ILD)治療的尼達(dá)尼布。此外,還有輝瑞的西地那非獲批新適應(yīng)癥——治療肺動(dòng)脈高壓(詳見表2)。

上半年,多款生物藥在我國成功拓展新適應(yīng)癥。其中,艾伯維的全人源抗腫瘤壞死因子(TNFi)單克隆抗體阿達(dá)木單抗(修美樂)獲批新適應(yīng)癥較多。作為艾伯維旗下重磅產(chǎn)品,該藥自2010年首次在我國獲批用于類風(fēng)濕關(guān)節(jié)炎治療以來,已相繼獲批7項(xiàng)適應(yīng)癥——今年1月份獲批用于中重度活動(dòng)性成人克羅恩病治療;3月份獲批用于非感染性中間葡萄膜炎、后葡萄膜炎和全葡萄膜炎治療,該適應(yīng)癥曾被納入臨床急需境外新藥名單;同月獲批用于兒童斑塊狀銀屑?。╬Ps)和多關(guān)節(jié)型幼年特發(fā)性關(guān)節(jié)炎(pJIA)治療。
此外,備受矚目的PD-1抗體斬獲更多適應(yīng)癥。PD-1抗體等免疫檢查點(diǎn)抑制劑,通過與相應(yīng)配體結(jié)合,消除對(duì)T細(xì)胞活性的抑制,從而提高T細(xì)胞殺傷腫瘤的能力。這類療法問世后,已被用于治療多種癌癥,并有望擴(kuò)展至更多實(shí)體瘤和血液瘤的治療。
在我國,首個(gè)PD-1抗體獲批至今已有兩年時(shí)間。此間,相關(guān)企業(yè)努力為其布局更多新適應(yīng)癥。上半年,PD-1抗體領(lǐng)域有6項(xiàng)新適應(yīng)癥獲得批準(zhǔn)。其中,恒瑞醫(yī)藥研發(fā)的卡瑞利珠單抗(艾瑞卡)收獲頗豐,該藥物先是在3月份獲批用于晚期肝細(xì)胞癌治療,成為我國企業(yè)研發(fā)的首個(gè)獲批肝癌適應(yīng)癥的PD-1抑制劑。隨后,在6月份又一舉拿下肺癌、食管癌領(lǐng)域兩個(gè)適應(yīng)癥。加上首個(gè)獲批的復(fù)發(fā)或難治性經(jīng)典型霍奇金淋巴瘤適應(yīng)癥,目前卡瑞利珠單抗共獲批4大適應(yīng)癥。
此外,百濟(jì)神州的替雷利珠單抗則通過優(yōu)先審評(píng)獲得第二項(xiàng)適應(yīng)癥——尿路上皮癌,其另外3個(gè)適應(yīng)癥也已提交上市申請(qǐng);百時(shí)美施貴寶的Opdivo獲得了第三項(xiàng)適應(yīng)癥——胃或胃食管連接部腺癌;默沙東的Keytruda獲得第五項(xiàng)適應(yīng)癥——二線治療食管癌。
除以上品種外,還有安進(jìn)的地舒單抗、諾華的司庫奇尤單抗、楊森的烏司奴單抗、德國默克的西妥昔單抗、禮來的度拉糖肽、諾和諾德的利拉魯肽等多款生物藥斬獲新適應(yīng)癥。
9款臨床急需境外新藥獲批
臨床急需境外新藥名單的公布及優(yōu)先審評(píng)審批制度的實(shí)施,加快了一些針對(duì)罕見病、嚴(yán)重危及生命或嚴(yán)重影響生活質(zhì)量的疾病治療藥物在我國上市速度。據(jù)不完全統(tǒng)計(jì),自臨床急需境外上市藥品目錄發(fā)布至今,國家藥監(jiān)局已批準(zhǔn)36個(gè)品種進(jìn)口注冊。其中包括今年上半年批準(zhǔn)的9款(詳見表3),與上年同期相比,批準(zhǔn)數(shù)量有所增長。往年獲批情況顯示,一般情況下下半年獲批數(shù)量均超過10款,預(yù)計(jì)今年全年將會(huì)有更多臨床急需境外新藥在我國獲批上市。
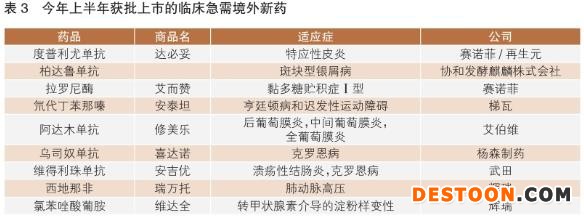
值得一提的是,輝瑞普強(qiáng)旗下枸櫞酸西地那非片上市申請(qǐng)2019年9月獲國家藥監(jiān)局藥品審評(píng)中心(CDE)受理,2020年2月即通過優(yōu)先審評(píng)獲批上市,歷時(shí)僅4個(gè)半月,成為在我國首個(gè)被批準(zhǔn)用于治療肺動(dòng)脈高壓的5型磷酸二酯酶(PDE-5)抑制劑,當(dāng)屬臨床急需境外新藥在我國成功獲得加速批準(zhǔn)的典型范例。
在這些獲批的臨床急需境外新藥中,有多款“首個(gè)”值得關(guān)注。賽諾菲近日獲批的重磅抗炎療法度普利尤單抗注射液,是全球首個(gè)也是唯一獲批治療成人中重度特應(yīng)性皮炎的靶向生物制劑;注射用拉羅尼酶濃溶液是全球首個(gè)、目前唯一獲準(zhǔn)治療黏多糖貯積癥Ⅰ型(MPSⅠ)的酶替代療法,同時(shí)也是我國唯一治療MPSⅠ的特異性治療藥物。梯瓦公司用于治療與亨廷頓?。℉D)有關(guān)的舞蹈病及成人遲發(fā)性運(yùn)動(dòng)障礙(TD)的創(chuàng)新藥物氘代丁苯那嗪片,則是國家藥監(jiān)局和美國FDA批準(zhǔn)的第一個(gè)氘代產(chǎn)品。
本土創(chuàng)新藥企業(yè)成績喜人
在39款獲批新藥中,有9款產(chǎn)品屬于我國本土創(chuàng)新企業(yè),其中7款為首次獲批。它們是百濟(jì)神州的BTK抑制劑澤布替尼、北??党傻腍ER2陽性乳腺癌藥物奈拉替尼、豪森藥業(yè)的非小細(xì)胞肺癌治療藥物阿美替尼、凱因科技的丙型肝炎藥物鹽酸可洛派韋膠囊、銀谷制藥的過敏性鼻炎藥物苯環(huán)喹溴銨鼻噴霧劑、復(fù)星醫(yī)藥首個(gè)引進(jìn)的血小板減少癥新藥阿伐曲泊帕、三生國健藥業(yè)乳腺癌新藥伊尼妥單抗。其中,北??党傻哪卫婺岷蛷?fù)星醫(yī)藥的阿伐曲泊帕均為從海外引進(jìn)的產(chǎn)品。
百濟(jì)神州澤布替尼的獲批備受關(guān)注。該品于今年6月在我國通過優(yōu)先審評(píng)審批程序附條件批準(zhǔn)上市,首次獲批兩項(xiàng)適應(yīng)癥,包括套細(xì)胞淋巴瘤(MCL)和慢性淋巴細(xì)胞白血?。–LL)/小淋巴細(xì)胞淋巴瘤(SLL)。此外,它還是首個(gè)獲得美國FDA授予“快速通道”“加速審評(píng)”“突破性療法”和“優(yōu)先審評(píng)”四大特殊通道資格認(rèn)定的中國自主研發(fā)抗癌新藥,去年11月率先在美國獲批。
此外,凱因科技開發(fā)的國產(chǎn)1類新藥鹽酸可洛派韋膠囊,通過抑制NS5A蛋白而阻斷HCV病毒的復(fù)制和組裝,于今年2月在我國獲批用于治療成人慢性丙型肝炎病毒(HCV)感染。
來源:醫(yī)藥網(wǎng)
來源:醫(yī)藥網(wǎng)



 110102000668(1)號(hào)
110102000668(1)號(hào)