近日,生物類似藥領(lǐng)域暗流涌動。往遠(yuǎn)處看,韓國藥企Celltrion宣布,其利妥昔單抗生物類似藥Truxima至今年第二季度,在英國、法國、意大利、德國和西班牙的市場份額合計已達(dá)46%,這5國約占?xì)W洲利妥昔單抗市場的70%。從整個歐洲市場來看,該藥的份額也超過了40%,歐洲市場又一原研藥被類似藥趕超。
近看國內(nèi)市場,競爭形勢更為激烈。以貝伐珠單抗為例,生物類似藥全面開花,并已形成“1+6”格局:貝達(dá)的貝伐珠單抗生物類似藥剛剛獲批。稍早前,羅氏的貝伐珠單抗獲批兩項婦科腫瘤新適應(yīng)證,而百奧泰的貝伐珠單抗生物類似藥獲批非小細(xì)胞肺癌和結(jié)直腸癌兩種適應(yīng)證。國內(nèi)還有齊魯、信達(dá)、綠葉和恒瑞等實力選手,今年上半年,在重點省市公立醫(yī)院西藥銷量前10的藥品中,齊魯?shù)呢惙ブ閱慰乖鏊僮羁欤袌龇蓊~趕超原研藥,加之復(fù)宏漢霖、康寧杰瑞等20余家企業(yè)仍在該領(lǐng)域競跑,競爭態(tài)勢異常激烈。
足見,生物類似藥在全球范圍內(nèi)強勢崛起,尤其在中國更是勢如破竹。
卡位戰(zhàn)賽況焦灼
當(dāng)前,臨床上熱銷的重磅生物藥均面臨著其類似藥的全面沖擊。
利妥昔單抗生物類似藥在歐洲趕超原研藥。而在中國,2019年復(fù)宏漢霖的利妥昔單抗生物類似藥在國內(nèi)獲批上市后,首個國產(chǎn)生物類似藥打破原研藥十?dāng)?shù)年的市場獨占。信達(dá)隨后跟進(jìn),相關(guān)臨床試驗還有10多項,處于臨床Ⅲ期以上的就有7家。
由此帶來的局面是,截至今年上半年,首款利妥昔單抗生物類似藥已完成國內(nèi)30個省市的醫(yī)保開通,七成以上核心醫(yī)院實現(xiàn)進(jìn)藥,2020年在國內(nèi)銷售額快速增長,而原研藥Rituxan在中國區(qū)的銷售額則下降23%。
不僅如此,利妥昔單抗的全球競爭更加白熱化。在生物類似藥最成熟的歐洲市場,首個獲批的利妥昔單抗生物類似藥已反超原研藥。分析歐洲替代曲線可以看到:首個生物類似藥上市后平均5年占市場份額(含原研藥和生物類似藥)超過40%。平均而言,在歐洲生物藥市場,首個上市生物類似藥具有先發(fā)優(yōu)勢,Truxima用最新數(shù)據(jù)豐富了這一曲線。國內(nèi)首款利妥昔單抗生物類似藥也在哥倫比亞、秘魯、厄瓜多爾及委內(nèi)瑞拉等拉美國家布局,生物藥的全球競爭更加充分。
處于同樣局面的生物藥還有貝伐珠單抗。截至今年11月,F(xiàn)DA批準(zhǔn)的31個生物類似藥中,貝伐珠單抗類似藥尤為搶眼,新獲批的Mvasi和Zirabev:前者2019年在Avastin專利到期后正式在美銷售,上市第2年就取得7.98億美元的收入;后者2020年首年銷售額達(dá)1.43億美元,這些類似藥給原研藥帶來巨大競爭壓力。
表1 上半年重點省市公立醫(yī)院西藥銷量前10藥品
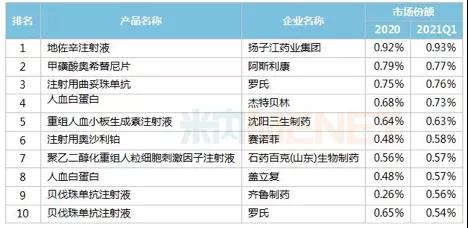
數(shù)據(jù)來自:米內(nèi)網(wǎng)數(shù)據(jù)庫
在國內(nèi),已上市銷售的貝伐珠單抗中,原研藥與齊魯?shù)纳镱愃扑幐饔星铮渌a(chǎn)品因商業(yè)布局尚在起步階段,市占率較低。從趨勢看,后來者或通過適應(yīng)癥差異化策略突圍,如貝達(dá)與復(fù)宏漢霖選擇了轉(zhuǎn)移性結(jié)直腸癌適應(yīng)癥,區(qū)別于目前國內(nèi)已上市的貝伐珠單抗生物類似藥;或是向海外延伸,如信達(dá)積極布局了美國和加拿大及印度尼西亞的海外權(quán)益。百奧泰與諾華子公司Sandoz合作將貝伐珠單抗類似藥有條件在歐美及加拿大等國際市場擴展,全面多維競爭格局一觸即發(fā)。
就阿達(dá)木單抗而言,近年艾伯維的Humira全球銷售額在增長,但在國內(nèi)銷售額卻逐步下滑,且銷售規(guī)模遠(yuǎn)低于歐美市場,替代潛力也很大。百奧泰、海正等企業(yè)已上位,外加46個臨床試驗仍在進(jìn)行。包含阿達(dá)木單抗在內(nèi)的重磅生物藥加速分化,在價格逐漸縮小差距的情況下,適應(yīng)癥成為決勝的關(guān)鍵,阿達(dá)木單抗目前國內(nèi)適應(yīng)癥偏少,因而生物類似藥在這場“叢林法則”的較量中表現(xiàn)突出。
同質(zhì)化加劇,市場代替拼速度
盡管生物類似藥惹人關(guān)注,但這也并非機會均等的盛宴。如果把這種競爭格局聚焦到中國市場來觀察,爭一保二遠(yuǎn)觀三四將是未來的競爭要塞。
首先,生物類似藥在臨床上的應(yīng)用逐漸得到認(rèn)可。CDE發(fā)布的《生物類似藥相似性評價和適應(yīng)癥外推技術(shù)指導(dǎo)原則》強調(diào),通過擬外推適應(yīng)癥相關(guān)研究數(shù)據(jù)和信息的科學(xué)論證,支持其用于參照藥中國獲批的其他未經(jīng)直接研究的適應(yīng)癥。
在此情況下,生物類似藥大展拳腳需差異化適應(yīng)癥策略和研發(fā)速度的比較優(yōu)勢。類似藥在歐洲市場份額平均達(dá)到44.1%,后來者在搶占市場方面稍顯乏力。如被EMA批準(zhǔn)上市的Remicade第二個生物類似藥Flixabi進(jìn)入歐洲市場后,在與原研和首家生物類似藥的角逐下,第一年搶到0.7%的市場份額,第二年市場份額占比上升到3.4%,但不到原研藥上市第二年市場份額的1/3。若以此類推,國內(nèi)生物藥市場也將面臨著同樣的考驗。
圖1 不同靶點的臨床試驗數(shù)量

數(shù)據(jù)來自:《中國新藥注冊臨床試驗現(xiàn)狀年度報告》
2020年國內(nèi)藥物臨床試驗有2602項,較上年增長9.1%,國內(nèi)申辦者占比超過70%,且前10位靶點中有9個靶點的藥物集中在同一適應(yīng)癥上,其中7個靶點的藥物品種的適應(yīng)癥超過90%的占比集中在抗腫瘤領(lǐng)域。這說明腫瘤藥創(chuàng)新繁榮的背后,誰能先人一步獲批上市關(guān)乎市場成敗。
而奮楫者先在現(xiàn)實中也遇到新挑戰(zhàn):受試者招募日漸成為影響臨床試驗速度的關(guān)鍵要素。目前PD-1、VEGFR等靶點的品種開展的臨床試驗均超過60項;另外,6個靶點的藥物臨床試驗中Ⅰ期的占比均超過40%,Ⅱ期臨床試驗在各靶點中的占比均不高,而PD-1、VEGFR等靶點的臨床試驗Ⅲ期均高達(dá)20項。
表2 臨床試驗?zāi)繕?biāo)入組人數(shù)分布
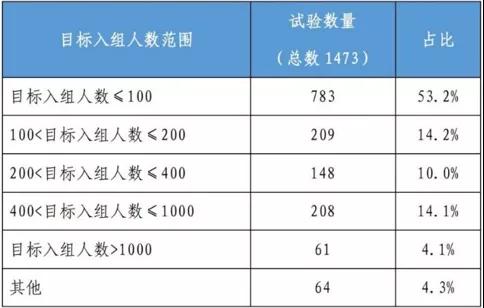
數(shù)據(jù)來自:《中國新藥注冊臨床試驗現(xiàn)狀年度報告》
官方披露,2020年登記的臨床試驗中,臨床試驗獲批后一年內(nèi)啟動受試者招募的比例不足一半(45.4%);2020年完成的臨床試驗中仍以Ⅰ期臨床試驗為主,2020年的藥物臨床試驗仍以國內(nèi)臨床試驗為主,占比達(dá)91.6%,國際多中心試驗僅占8.1%,包括生物類似藥在內(nèi)的國內(nèi)競爭會更激烈。目前,貝伐珠單抗、曲妥珠單抗等上述熱銷類似藥臨床研究都在延伸至海外。然而,對不在中國招募受試者或僅在國外開展的單中心臨床試驗,其占比僅為0.3%;國際多中心試驗占比相對較高,為14.1%。不少企業(yè)反饋,“臨床試驗的時間成本和機會成本在增加。”受試者資源緊張,必然影響項目的速度和占位。
成本優(yōu)勢取勝,實現(xiàn)覆蓋最大化
盡管生物類似藥臨床應(yīng)用仍有不同觀點,且雖已證實生物類類藥與原研生物藥的安全性有效性無顯著性差別,但客觀來講,針對臨床用藥互換的研究總體上仍待加強。臨床證據(jù)有限也影響了臨床用藥的態(tài)度。有專家建議,政策上應(yīng)多鼓勵企業(yè)報告上市后生物類似藥與原研生物藥在不同轉(zhuǎn)換場景中患者安全性和免疫原性等數(shù)據(jù)。
況且,胰島素完成帶量采購后,生物藥集采擴面肯定還會加碼。
因而,產(chǎn)品上市后,還得考驗成本優(yōu)勢及產(chǎn)品覆蓋能力。在保障高品質(zhì)的同時拼成本優(yōu)勢將是大趨勢。最近,默克利用在抗體強化工藝、連續(xù)工藝過程設(shè)備、經(jīng)濟適用型培養(yǎng)基開發(fā)等方面的優(yōu)勢,與博安生物的平臺技術(shù)及產(chǎn)業(yè)鏈合作,將進(jìn)一步提升其生產(chǎn)效能,優(yōu)化生產(chǎn)成本,這種合作遠(yuǎn)超單一產(chǎn)品的商業(yè)價值。
博安生物的貝伐珠單抗生物類似藥“前有猛虎,后有追兵”,其商業(yè)化打法就是除自建商業(yè)團隊外,選擇與阿斯利康合作,授權(quán)后者在中國21個省市區(qū)的縣域地區(qū)獨家推廣該藥品,通過資源協(xié)同實現(xiàn)產(chǎn)品覆蓋最大化,這在生物類似藥競爭策略中是很重要的一個切入點。
百奧泰也深諳此道。今年年初,忍痛連續(xù)砍掉2個ADC藥物研發(fā)項目,通過瘦身行動聚焦,其2021年中報顯示,在研13款藥物當(dāng)中,貝伐珠單抗、托珠單抗、司庫奇尤單抗及戈利木單抗4款生物類似藥的累計研發(fā)投入達(dá)11.3億元,占到總研發(fā)費用的近75%,百奧泰希望在靶點成熟品種中做到同類最佳。去年8月,其將貝伐珠單抗在中國的商業(yè)化權(quán)益給了百濟神州以謀求更大的渠道覆蓋,能否沖出“叢林”有待市場檢驗。
隨著跨國企業(yè)在中國的可持續(xù)發(fā)展,逐漸以中國為中心加強本地化,而中國的創(chuàng)新企業(yè)要可持續(xù)發(fā)展,也在逐步國際化,生物藥之間的競爭也將更加錯綜復(fù)雜,有了產(chǎn)品還考驗企業(yè)的綜合實力。



